Борьба с вирусными и бактериальными инфекциями:
механизм действия комплексного препарата РИБАФЛОКС
С. В. Парилов, ветеринарный врач, к. б. н.
 Вирусные болезни животных продолжают оставаться одним из наиболее
Вирусные болезни животных продолжают оставаться одним из наиболее
актуальных вопросов
в ветеринарной практике. Многие возбудители, сохраняя
способность к высокой изменчивости
и быстрому распространению,
наносят огромный экономический ущерб сельскому хозяйству
мира и России в частности.
Именно поэтому особое внимание уделяется профилактике данных
заболеваний,
состоящей из комплекса мер – вакцинация, дезинфекция, организационные
мероприятия и так далее. Однако несмотря на все предпринимаемые усилия
сохраняется риск
заноса инфекции. В случае с бактериальной этиологией можно
применить широчайший спектр
антибиотиков, предлагаемых сегодня на рынке ветеринарных препаратов. Но что касается
противовирусной терапии, то тут ассортимент
доступных препаратов не так велик.
В этой статье рассмотрены научные данные об одном из противовирусных препаратов группы нуклеозидных аналогов – «Рибавирине». Впервые опубликованные в 1972 году данные о нем (препарат «Виразол») [31] показали активность против 16 РНК и ДНК исследованных вирусов, в числе которых были герпес-вирус, вирусы везикулярного стоматита, гриппа А, парагриппа-1 и так далее. При этом вещество характеризуется низкой токсичностью, исключая обратимую анемию, обычно легкой степени [24], и противопоказания при текущей или планируемой в течение ближайших 6 месяцев беременности [40]. А мультиплицированный механизм действия означает, что резистентность к препарату вырабатывается очень редко. В настоящее время рибавирин назначают людям при широком спектре заболеваний вирусной этиологии, таких как гепатит C, респираторно-синцитиальная инфекция, лихорадки Ласса, долины Рифт, конго-крымская и другие [5, 6, 7, 20]. Также было изучено его действие на возбудителя COVID-19 [2].
Разработанная более 40 лет назад молекула сразу представляла практический интерес,
во многом связанный с тем, что это был первый синтетический нуклеозид, демонстрирующий
широкий спектр антивирусной активности, и один из немногих противовирусных препаратов,
клинически эффективный не только против вируса герпеса и ВИЧ [21]. Он хорошо
зарекомендовал себя и получил широкое распространение в медицинской практике,
но в ветеринарии его применение только набирает обороты.
В чем же заключается секрет успеха рибавирина? Чтобы ответить на этот вопрос, необходимо
разобраться в механизме его действия.
Как известно, кодирующая генетическую информацию нуклеиновая кислота (НК)
есть не только у животных и растений, но и у вирусов. Собственно говоря, вирусы состоят
из генетического материала (ДНК или РНК), белковой оболочки (капсида) и иногда липидных
оболочек.
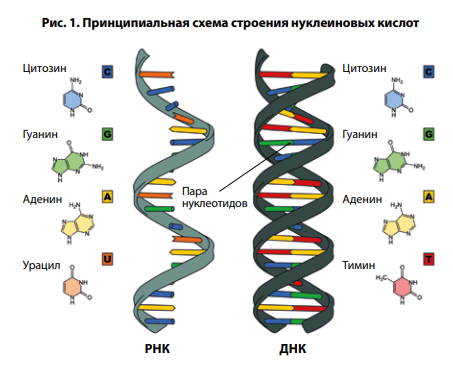
Нуклеиновая кислота, в свою очередь, состоит из остатка фосфорной кислоты, одного из двух сахаров – рибозы либо дезоксирибозы (в РНК и ДНК соответственно) –
и нескольких азотистых оснований: цитозина, гуанина, аденина и урацила (для РНК) либо тимина (для ДНК). Различные комбинации этих азотистых оснований и являются
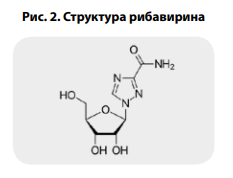
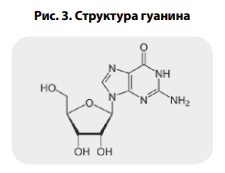
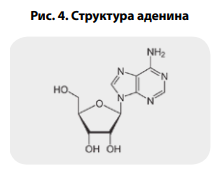
элементом кодирования (рис. 1). Проведенная рентгеновская кристаллография рибавирина показала схожесть его структуры с гуанином (рис. 2–4) [27].
 МЕХАНИЗМ
ДЕЙСТВИЯ РИБАВИРИНА
МЕХАНИЗМ
ДЕЙСТВИЯ РИБАВИРИНА
По последним данным, известно несколько механизмов действия [21, 28]. Рассмотрим наиболее изученные.
1. Рибавирин является конкурентным ингибитором инозин-5’-монофосфатдегидрогеназы (IMPDH)
Гуанин, как уже было сказано
выше, является составной частью
как ДНК, так и РНК. При синтезе
азотистых оснований de novo метаболиты рибавирина ингибируют фермент IMPDH, необходимый
для синтеза гуанозинмонофосфата (нуклеотида, содержащего гуанин), в результате возникает дефицит этого нуклеотида
и тормозится построение мРНК.
Как следствие, снижается синтез
белков [6, 25].
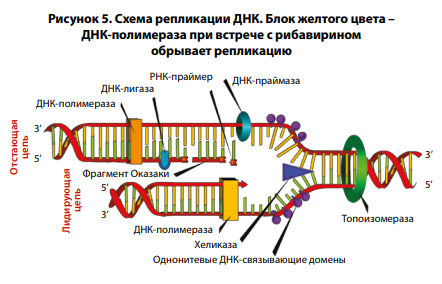
2. Ингибирование
полимеразы ДНК-вирусов
Следующее действие рибавирина
связано с ферментами, участвующими в репликации нуклеиновой
кислоты, то есть в процессе создания двух дочерних молекул на
основе родительской. Ферменты
класса полимераз запускают копирование исходной НК. Однако
в случае, когда полимераза доходит до трифосфата рибавирина
(вместо трифосфата гуанина), происходит обрыв цепи и ингибирование репликации вирусной ДНК
(рис. 5).
3. Ингибирование
полимеразы РНК-вирусов
Исследования показали, что
трифосфат рибавирина также
оказывает ингибирующее действие и на некоторые полимеразы РНК-вирусов, такие как вирус
везикулярного стоматита, гриппа и так далее [15].
В случае с РНКзависимой РНК-полимеразой
ингибирование идет не по классическому прерыванию. Здесь
значительную роль играет конкурентное связывание с естественными нуклеотидами. Это было
продемонстрировано на примере
вирусной диареи КРС [15].
4. Ингибирование
вирусного кэпирования
Один из способов защиты
клетки-хозяина от вируса – это
ферменты нуклеазы. Эти ферменты разрушают фосфодиэфирную
связь между нуклеотидами, тем
самым приводят к деградации вирусной мРНК [30]. Для ее стабилизации эукариотические клетки
и некоторые вирусы выработали специальную защиту – кэпирование (от англ. Cap – шапка)
[16, 30]. Кэп состоит из одного или
нескольких модифицированных
нуклеозидов, защищающих от быстрой деградации, способствующих экспорту мРНК из ядра и процессингу. В клетках эукариотов только кэпированные мРНК могут
быть стабильны и транслироваться. Напротив, некэпированные
мРНК быстро подвергаются деградации и могут стать причиной
активации антивирусной защиты
клетки. Коэволюция вирусов и их
хозяев привела к возникновению
у вирусов различных механизмов
преодоления этой защиты [8].
• Кэпирование ферментами хозяина характерно для лейкоза
КРС, кошачьих, ВИЧ.
• Кэпирование ферментами вируса – для возбудителей нодулярного дерматита, КЧС и ВД КРС.
• Некоторые вирусы «крадут» кэп
(вирус гриппа).
Однако вирусный фермент неэффективно модифицирует кэпированные рибавирином РНК. В
результате синтезируются псевдокэпированные мРНК, которые
стабильны в клетке, но практически не транслируются в вирусные
белки.
5. Рибавирин трифосфат (РТФ) –
мутаген для вирусной РНК
Как уже было описано выше,
рибавирин трифосфат может
встраиваться в нуклеиновую кислоту вместо гуанина. При этом
репликация прерывается, когда
полимераза доходит до замещенного участка. Некоторые вирусы
имеют повышенную адаптацию к
меняющимся окружающим условиям и иммунному ответу (вирус
гепатита С, близкий к нему вирус
ВД КРС). Вариабельность генетических мутаций обусловлена
квазиспецифичными полимеразами. Отличительной чертой их
является не прерывание репликации НК, как это происходит обычно, а продолжение, несмотря на
ошибки [12, 13]. Однако вирус при
этом становится у опасной черты летального мутагенеза, когда
при накоплении критического
количества ошибок значительно
снижается живучесть вирионов.
Также исследование показало,
что полимераза вируса гепатита С
может неправильно включать рибавирин в качестве пуринового
аналога в противоположность нуклеиновым основаниям цитидина
и урацила, что стало биохимическим подтверждением теории вирусного мутагенеза [28].
Кроме описанных выше прямых действий рибавирина, был также обнаружен иммуномодулирующий и противовоспалительный эффект [21, 28]. Рибавирин применяется как в монотерапии, так и в комбинации с другими препаратами [14, 17]. В ветеринарии рибавирин продемонстрировал свою активность против вируса чумы плотоядных [9, 10], парагриппа и калицивируса [26, 36], инфекционного перитонита кошек [35], респираторно-синтициальной инфекции [1, 19, 36], вирусной диареи КРС [11, 32, 33, 36, 37, 38], цирковируса [4], РРСС [34], ТГС [39], ротавируса, лейкоза КРС [22, 32].
Как показывает практика, большинство этих болезней редко приходят одни. Обычно за ними следуют секундарные инфекции как вирусной, так и бактериальной этиологии. Этот момент был учтен при составлении рецептуры комплексного препарата Рибафлокс®, имеющего рибавирин, энрофлоксацин и триметоприм в своем составе.
Энрофлоксацин – антибиотик широкого спектра, относящийся к группе фторхинолонов, действующий на грамположительные и грамотрицательные бактерии и микоплазму как на стационарной стадии, так и на стадии роста. Энрофлоксацин блокирует фермент ДНК-гиразу, что приводит к нарушению синтеза ДНК, а также роста и деления бактерий, вызывает выраженные морфологические изменения (в том числе клеточной стенки и мембран) и гибель бактериальной клетки [23].
Триметоприм, входящий в состав препарата, является производным соединением из группы диаминопиримидинов, механизм действия которого связан с угнетением фермента дигидрофолатредуктазы в процессе синтеза тетрагидрофолиевой кислоты, предшественника фолиевой кислоты, которая является важнейшим фактором жизнедеятельности микроорганизмов [3].
Оба эти компонента уже зарекомендовали себя в ветеринарной практике и в составе комплексного препарата позволяют бороться с широчайшим спектром инфекционных болезней животных, а именно с такими возбудителями, как E.coli, Klebsiella spp., Salmonella spp., Enterobacter spp., Proteus spp., Haemophilus spp., Chlamydia, Boгdetella spp., Clostridium spp, Erysipelothrix spp., Pasteurella spp., Corynebacterium spp., Pseudomonas spp., Campylobacteг spp., Bacteroides spp., Actinobacillus pleuropneumoniae, Fusobacteriun, Brucella spp., Streptococcus pneumoniae, Staphylococcus spp., Listeria monocytogenes, а также Mycoplasma spp.
Рибафлокс® производства ALPOVET LTD является первым лекарственным средством с такой инновационной рецептурой на отечественном рынке ветеринарных препаратов. Появившись около десяти лет назад, он успел себя зарекомендовать среди ветеринарных врачей мелких домашних, экзотических, а также с/х животных. Его уникальная запатентованная формула обеспечивает стабильность и высокую биодоступность активных компонентов препарата. Наиболее широкое применение Рибафлокс® получил при лечении молодняка крупного рогатого скота, свиней, овец и коз, собак и кошек при инфекциях смешанной этиологии респираторной (бронхопневмонии, пневмонии, атрофического ринита), пищеварительной (гастроэнтерита, энтерита, колита), мочеполовой (синдром мастит-метрит-агалактия, цистит, пиелонефрит) систем, септицемии и других болезней, вызванных чувствительными к ингредиентам препарата вирусами и бактериями.
Использованные источники:
1. Bartzatt R, Anderson GA. Ribavirin inhibits proliferation of bovine respiratory syncytial virus in vitro. Comp Immunol Microbiol Infect Dis. 1989;
v. 12(3), p. 57–62.
2. Bojkova D., Klann K, Koch B, еt al. Proteomics of SARS-cov-2-infected host cells reveals therapy targets. Nature (2020). Https://doi.org/10.1038/
s41586-020-2332-7.
3. Brogden R. N., Carmine A. A., Heel R. C., Speight T. M., Avery G. S. Trimethoprim: a review of its antibacterial activity, pharmacokinetics and
therapeutic use in urinary tract infections. Drugs. 1982; v. 23(6), p. 405–430.
4. Chen J, Li W., Jin E, et al. The antiviral activity of arctigenin in traditional Chinese medicine on porcine circovirus type 2. Research in Veterinary
Science. 2016; v. 106, p. 159–164.
5. Cramp ME, Rossol S, Chokshi S, Carucci P, Williams R & Naoumov NV Hepatitis C virus-specific T-cell reactivity during interferon and ribavirin
treatment in chronic hepatitis C. Gastroenterology v. 118, p. 346–355.
6. Crotty S, Cameron, C. & Andino, R. Ribavirin's antiviral mechanism of action: lethal mutagenesis? J Mol Med 80 (2002), p. 86–95.
7. Crumpacker CS Overview of ribavirin treatment of infection caused by RNA viruses. In Clinical Applications of Ribavirin. Edited by RA Smith,
V Knight & JAD Smith. Florida: Academic Press 1984, p. 33–37.
8. Decroly E, Ferron F, Lescar J, Canard B. Conventional and unconventional mechanisms for capping viral mRNA. (англ.) // Nat Rev Microbiol.:
journal. – 2011. – Vol. 10. – P. 51–65.
9. El-Gallad SB. Investigation of the antiviral effect of ribavirin and acyclovir on canine distemper and infectious canine hepatitis viruses. Suez Canal
Vet Med J. 2008; v. 13, p. 555–563.
10. Elia G, Belloli C, Cirone F, et al. In vitro efficacy of ribavirin against canine distemper virus. Antiviral Res. 2008; v. 77, p. 108–113.
11. Escuret, Vanessa & Parvaz, Parviz & Hantz, Olivier & Petit, Marie-Anne & Trepo, Christian & Zoulim, Fabien. Study of the antiviral
mechanism of action of ribavirin in the bovine viral diarrhea virus model. Gastroentérologie clinique et biologique.
2002, v. 26, p. 584– 590.
12. Farci P & Purcell RH Clinical significance of hepatitis C virus genotypes and quasispecies. Seminars in Liver Disease,
2000 v. 20, p. 103–126.
13. Farci P, Bukh J & Purcell RH The quasispecies of hepatitis C virus and the host immune response. Springer Seminars
in Immunopathology 1997 v. 19, p. 5–26.
14. Fernandez H, Banks G & Smith R. Ribavirin: A clinical overview. Eur J Epidemiol 1986, v. 2, p. 1–14.
15. Fernandez-Larsson R, O’Connell K, Koumans E & Patterson JL. Molecular analysis of the inhibitory effect of phosphorylated ribavirin on the
vesicular stomatitis virus in vitro polymerase. Antimicrob Agents Chemother. 1989 Oct; 33 (10), p. 1668–1673.
16. Furuichi Y, Shatkin AJ. Viral and cellular mRNA capping: past and prospects. // Adv Virus Res.: journal. – 2000. – Vol. 55. – P. 135–184.
17. Glanville, Allan R. et al. Intravenous Ribavirin Is a Safe and Cost-effective Treatment for Respiratory Syncytial Virus Infection After Lung
Transplantation. The Journal of Heart and Lung Transplantation, Vol. 24, Issue 12, p. 2114–2119.
18. Hong Z, Ferrari E, Wright-Minogue J, Skelton A, Glue P, Zhong W & Lau Jyn. Direct antiviral activity of ribavirin: hepatitis C virus NS5B polymerase
incorporates ribavirin triphosphate into nascent RNA products. Hepatology 1999, 32, p. 354A.
19. Hruska JF, Bernstein JM, Douglas RG Jr, Hall CB. Effects of ribavirin on respiratory syncytial virus in vitro. Antimicrob Agents Chemother.
1980 May; 17 (5), p. 770–775.
20. Huggins JW. Prospects for treatment of viral hemorrhagic fevers with ribavirin, a broad-spectrum antiviral drug. Rev Infect Dis.
1989 May – Junе; 11 Suppl 4, p. 750–761.
21. Jason D. Graci and Craig E. Cameron. Mechanisms of action of ribavirin against distinct viruses. Rev. Med. Virol. 2006, 16, р. 37–48.
22. Jeff Isaacson, Charles Wood, Jay Reddy. Synergistic Inhibition of Bovine Leukemia Virus Replication In Vitro by Ribavirin and alpha-Interferon.
2009 May. Antiviral Research 82 (2).
23. Mark G Papich. Saunders Handbook of Veterinary Drugs (Fourth Edition). Small and Large Animal. Enrofloxacin. 2016, p. 287–289.
24. Noel J C Snell Ribavirin – current status of a broad spectrum antiviral agent, Expert Opinion on Pharmacotherapy.
2001, 2 (8), p. 1317–1324.
25. Ortega-Prieto AM, Sheldon J, Grande-Pérez A, Tejero H, Gregori J, Quer J, Esteban JI, Domingo E, Perales C. Extinction of hepatitis C virus by
ribavirin in hepatoma cells involves lethal mutagenesis. PLoS One. Vartanian J (ed.). 2013, 8 (8): e71039.
26. Povey RC. In vitro antiviral efficacy of ribavirin against feline calicivirus, feline viral rhinotracheitis virus, and canine parainfluenza virus.
Am J Vet Res. 1978; v. 39, p. 175–178.
27. Prusiner P, Sundaralingam M. A new class of synthetic nucleoside analogues with broad-spectrum antiviral properties. Nat New Biol 1973;
244 (134), p. 116–118.
28. Robert C Tam, Johnson YN Lau and Zhi Hong. Mechanisms of action of ribavirin in antiviral therapies. Antiviral Chemistry & Chemotherapy
Volume: 12 issue: 5 (2001), p. 261–272.
29. Rollinson E. A., Prospects for antiviral chemotherapy in veterinary medicine: 2. Avian, piscine, canine, porcine, bovine and equine virus diseases.
Antiviral Chemistry& Chemotherapy. 1992, 3(6), p. 311–326.
30. Shatkin AJ (1976) Capping of eucaryotic mRNAs. Cell 9, p. 645–653.
31. Sidwell RW, Huffman JH, Khare GP, Allen LB, Witkowski JT, Robins RK. Broad-spectrum antiviral activity of Virazole: 1-beta-D-ribofuranosyl-1,
2,4-triazole-3-carboxamide. Science. 1972 Aug 25; 177 (4050), p. 705–706.
32. Sidwell RW, and Smee DF. Bovine leukemia virus. Inhibition in vitro by ribavirin. Antiviral Res 1981, 1, p. 47–53.
33. Stuyver LJ, Lostia S, Patterson SE, Clark JL, Watanabe KA, Otto MJ, et al. Inhibitors of the IMPDH enzyme as potential antibovine viral diarrhoea
virus agents. Antivir. Chem. Chemother. 2002; 13 (6), p. 345–352.
34. Tian D, and X. J. Meng. Amino acid residues Ala283 and His421 in the RNA-dependent RNA polymerase of porcine reproductive and respiratory
syndrome virus play important roles in viral Ribavirin sensitivity and quasispecies diversity. Journal of General Virology. 2016 Jan; 97 (1), p. 53–59.
35. Weiss RC, Oostrom-Ram T. Inhibitory effects of ribavirin alone or combined with human alpha interferon on feline infectious peritonitis viral
application in vitro. Vet Microbiol. 1989; v. 20, p. 255–265.
36. Глотов А. Г., Глотова Т. И., Сергеев А. А., Белкина Т. В., Сергеев А. Н. Противовирусная активность различных препаратов
in vitro в отношении вирусов инфекционного ринотрахеита и вирусной диареи крупного рогатого скота.
Вопросы вирусологии, 2004, т. 49, № 5. – С. 40–46.
37. Глотов А. Г., Глотова Т. И., Сергеев А. Н. Изучение антивирусных свойств препаратов различного происхождения в отношении
герпес-и пестивирусов крупного рогатого скота. Антибиотики и химиотерапия, 2004 г., т. 49, № 6. – С. 6–9.
38. Глотова Т. И., Никонова А. А., Глотов А. Г. Противовирусные соединения и препараты, эффективные в отношении вируса вирусной
диареи крупного рогатого скота. Вопросы вирусологии. – 2016, 62 (5). – С. 204–210.
39. Крайнова, В. И., Ястребов А. С., Ковалёв Н. А., Русяев В. А., Даниленко Г. И. Ингибирующее действие дейтофорина,
циклоцитидина-5-монофосфата и виразола (рибаверина) на коронавирусный трансмиссивный гастроэнтерит.
Вет. наука – производству. – 1983, 21. – С. 18–20.
40. Электронный ресурс Copedgus (PDF). FDA.gov. Archived (PDF) from the original on 3 November 2014
[дата обращения: 27 мая 2020].
