ООЦИСТЫ ЭЙМЕРИЙ – Как и чем уничтожить?
Компания: ООО «Рациовет»__________________________________________________________________________________________________________________________
Авторы:
Ринат Сафиуллин,
д-р ветеринар. наук, профессор ВНИИ
фундаментальной и прикладной паразитологии
животных и растений им. К.И. Скрябина –
филиал ФГБНУ ФНЦ ВИЭВ РАН;
Юрий
Краснобаев,
канд. биол. наук,
ветврач

При исследовании помета,
полученного от цыплят первой
опытной группы,
получивших
ооцисты, обработанные 0,5-процентным раствором
препарата
Вирукилл 260, в среднем
отмечено выделение ооцист
в количестве 3796 шт. на 1 г.
Вспышка заболевания эймериозом у птицы сопровождается значительным падежом, но благодаря усилиям ветеринарных специалистов с подобным явлением на производстве практически не сталкиваются. Разработаны специальные программы по использованию различных групп кокцидиоцитов и кокциодиостатиков, а также программы вакцинации долгоживущей птицы, но эффективность данных мероприятий напрямую зависит от санитарных условий.
Несмотря на широкий выбор препаратов, воздействующих на эндогенную стадию развития паразита, эффективность каждого из них со временем уменьшается. В связи с быстрой приспособляемостью эймерий требуется программа ротации. В окружающей среде в огромных количествах накапливаются ооцисты, из которых появятся резистентные к определенному действующему веществу эймерии. При этом ооциста очень устойчива к действию различных химических агентов и может сохранять жизнеспособность в течение длительного времени, что в конечном счете может привести к возникновению мультирезистентности.
В свою очередь, при вакцинации наличие полевых ооцист в доступе цыплят имеет еще больше негативных последствий. Для формирования иммунного ответа вакцинные штаммы ооцист должны несколько раз пройти через желудочно-кишечный тракт цыпленка. При этом противоэймериозные препараты не применяются, так как они в первую очередь повлияют на вакцинацию, а следовательно, раннее заражение полевыми штаммами может привести к вспышке заболевания, сведя к нулю эффект от вакцинации.
Таким образом, для успешной профилактики кокцидиоза одним из ключевых звеньев является эффективная, учитывающая специфику устойчивости ооцист подготовка корпуса. На ветеринарном рынке имеются предложения из нескольких препаратов с выраженной активностью против ооцист. Однако оценка их эффективности в условиях промышленного производства затруднена, так как может быть осуществлена в основном по косвенным показателям зоотехнического учета, подсчета ооцист в помете птицы или оценки поражения кишечника. При этих методах оценки ряд факторов могут наложиться друг на друга и исказить полученные выводы.
Мы решили протестировать дезинфектант широкого спектра действия Вирукилл 260 с целью оценки его эффективности в условиях вивария при искусственном заражении цыплят инвазионными ооцистами.
Препарат Вирукилл 260, разработанный английской компанией QuatChem, появился на российском рынке в 2018 году. Данный препарат имеет высокую бактерицидную, вируцидную и фунгицидную активность. Он рекомендован к применению в ветеринарии для дезинфекции и дезинвазии помещений для содержания животных и птицы.
В ходе работы в условиях вивария ВНИИ фундаментальной и прикладной паразитологии животных и растений им К.И. Скрябина по методу аналогов было сформировано шесть групп цыплят 14-дневного возраста, свободных от эймерий. Цыплятам первой, второй и третьей групп в первый день опыта дали внутрь орально суспензию, содержащую по 2000 ооцист эймерий, обработанных 0,5; 1 и 2-процентными растворами препарата Вирукилл 260 соответственно. Цыплятам четвертой группы дали такое же количество ооцист, но обработанных 4-процентным раствором фенола. Цыплята пятой группы получили аналогичное количество ооцист, не обработанных препаратами, и служили зараженным контролем. Цыплята шестой группы получили по 1 мл буферного раствора WSH и служили незараженным контролем.
За время опыта цыплята всех шести групп находились в аналогичных условиях содержания и имели одинаковый рацион. Начиная с шестого дня после заражения от цыплят каждой группы собирали помет и подсчитывали количество выделенных ооцист. Подсчет ооцист проводили в течение шести дней. Эффективность дезинвазии разных концентраций препарата Вирукилл 260, а также 4-процентной концентрации базового препарата фенола определяли, исходя из процента снижения выделения ооцист эймерий по сравнению с цыплятами контрольной группы.
Цыплята шестой группы, которые получали буфер WSH без ооцист и служили незараженным контролем, все сроки исследований оставались свободными от инвазии.
У цыплят пятой группы, получавших необработанные ооцисты, в период исследования установлено большее количество выделенных ооцист. В среднем оно составило 64880 ооцист в 1 г. Данный показатель был использован как исходный при расчете процента снижения количества ооцист в опытных группах или интенсэффективность препаратов.
При исследовании помета, полученного от цыплят первой опытной группы, получивших ооцисты, обработанные 0,5-процентным раствором препарата Вирукилл 260, в среднем отмечено выделение ооцист в количестве 3796 шт. на 1 г. Это составляет 5,85% от аналогичного показателя контрольной группы. Таким образом, интенсэффекивность препарата Вирукилл 260 в 0,5-процентной концентрации составила 94,15%.
Количество ооцист в 1 г помета, полученного от цыплят второй и третьей групп, которым давали суспензию ооцист, обработанную 1 и 2-процентной концентрацией Вирукилл 260, составило 1562 (2,41% от контроля) и 1190 (1,83% от контроля) соответственно. Исходя из полученных данных, интенсэффективность препарата Вирукилл 260 в 1-процентной концентрации составляет 97,6%, а в 2-процентной концентрации – 98,18%.
Эффективность базового препарата
(4-процентный раствор фенола) была ниже.
В 1 г помета у цыплят четвертой группы
в среднем содержалось 7300 ооцист. Таким
образом, интенсэффективность 4-процентного раствора фенола составила 88,75%.
Препарат Вирукилл 260,
разработанный английской компанией QuatChem,
появился на российском рынке в 2018 году.
Данный препарат имеет высокую
бактерицидную,
вируцидную и фунгицидную активность.
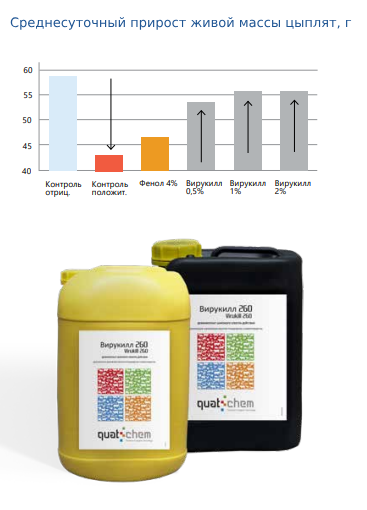
Через 17 дней после заражения живая масса цыплят первой, второй и третьей групп имела средний прирост к исходной массе тела 908,3; 948,5 и 95З,7 г, а среднесуточный прирост массы у них составил 5З,4; 55,8 и 56,1 г соответственно (рис. 1). Цыплята четвертой группы имели средний прирост к исходной массе тела 786,4 г, и среднесуточный прирост у них составил 46,3 г. Цыплята пятой группы (зараженный контроль) имели прирост к исходной массе тела 7З2,4 г и среднесуточный прирост 43,1 г. У цыплят шестой, контрольной группы, которые были свободны от эймерий, средний прирост к исходной массе тела составил 998,7 г, а среднесуточный прирост – 58,7 г.
В описанном исследовании наглядно показано, что развитие паразита в кишечнике птицы напрямую связано со снижением живой массы цыплят. Цыплята, получившие необработанные инвазионные ооцисты, имели прирост живой массы меньше на 26,58% по сравнению с незараженными. В условиях хозяйства это привело бы к значительному экономическому ущербу и потребовало экстренного ветеринарного вмешательства. Более важным результатом проведенного исследования является определение интенсэффективности препарата Вирукилл 260.
Данный препарат рекомендован к применению в период санитарного разрыва
в 1-процентной концентрации для обработки поверхностей, и, исходя из полученных
данных, уже в 0,5-процентной концентрации его интенсэффективность составила
94,15%. Это доказывает высокую эффективность препарата Вирукилл 260, который может быть применен для обработки
поверхностей методом орошения и методом пены. Данный процесс технологичен
и уже с успехом применяется на ряде птицефабрик России.
